PROJECT TITLE:
Lung Ultrasound Guided Fluid Management Protocol for the Critically Ill Patient: randomized controlled trial
PROJECT MANAGER:
Prof. Dr. Adrian Constantin Covic
“Grigore T. Popa” University of Medicine and Pharmacy, Iasi, Romania
Nephrology Department, “Dr. C.I. Parhon” University Hospital, Iasi, Romania
FUNDING INFORMATION:
Project number: PN-III-P4-ID-PCE-2016-0908
Project name from PN III: Project 4 – Fundamental and Frontier Research
Project Type: Exploratory Research Projects
Project Title: Lung Ultrasound Guided Fluid Management Protocol for the Critically Ill Patient: randomized controlled trial
Financing Contract for Project Execution: No 167/2017
Total amount of the contract: 850.000.00 RON
Funding sources:
Source 1: State Budget 850.000.00 RON
Source 2: Other sources 0 RON
Duration of the contract: 30 months
The contracting authority: The Executive Unit for Funding for Higher Education, Research, Development and Innovation (UEFISCDI)
Contractor: ”Grigore T. Popa” University of Medicine and Pharmacy Iasi
Rector/CEO: Prof. Dr. Viorel Scripcariu
CEO UEFISCDI: Adrian Curaj
PROJECT SETTINGS
Intensive Care Unit Department, Regional Institute of Oncology, Iasi
Intensive Care Unit Department, “Saint Spiridon” University Hospital, Iasi
Nephrology Department, “Dr. C.I. Parhon” University Hospital, Iasi (Coordinating center)
LOCAL COORDINATORS
Ioana Grigoras – local coordinator Regional Institute of Oncology, Iasi
“Grigore T. Popa” University of Medicine and Pharmacy, Iasi, Romania
Intensive Care Unit Department, Regional Institute of Oncology, Iasi, Romania,
Mihaela Blaj – local coordinator “Saint Spiridon” University Hospital, Iasi
“Grigore T. Popa” University of Medicine and Pharmacy, Iasi, Romania
Intensive Care Unit Department, “Saint Spiridon” University Hospital, Iasi, Romania
ETHICS APPROVAL
The trial was approved by the Research Ethics Committees of the Grigore T. Popa
University of Medicine and Pharmacy (date 14 November 2017, number 26261) and by the
Research Ethics Committees of each hospital involved in patient’s recruitment.
All patients sign an informed consent.
TRIAL STATUS
The trail is registered at ClinicalTrials.gov, ID: NCT03393065, registered on 8 January 2018.
https://clinicaltrials.gov/ct2/show/record/NCT03393065
Patients enrollment in the trial has started in November 2017 and is expected to end in
October 2019. Protocol version: 1.
Actual number of enrolled patients: 122 patients
PUBLICATIONS:
Lung Ultrasound Guided Fluid Management Protocol for the Critically Ill Patient: study
protocol for a multi-centre randomized controlled trial (Manuscript submitted to Trials, TRLS-S-18-01067, under evaluation)…..
STUDY PROTOCOL SUMARY
STUDY DESIGN
Lung ultrasound (LUS) Guided Fluid Management Protocol for the Critically Ill Patient is a multi-centre, randomized controlled two-arm trial, with 1:1 allocation of intensive care unit (ICU) patients to LUS guided fluid management or usual care.
The schedule of study procedures
OBJECTIVES
To evaluate a fluid management protocol for adult ICU patients, based on daily assessment of B-lines score (BLS) using LUS, compared to usual of care.
SETTINGS
The trial will be conducted in the ICUs of two university hospitals, Saint Spiridon University Hospital and Regional Institute of Oncology Iasi.
PARTICIPANTS
We aim to enroll 500 adult ICU patients during a period of 24 months.
Patients will be included in this study if they provide written informed consent to participate, are expected to stay at least 48 hours in the ICU, met at least one of the following inclusion criteria and have none of the exclusion criteria.
INCLUSION CRITERIA:
- Major surgery
- Major comorbidities associated to surgery
- Polytrauma with Injury Severity Score (ISS) ≥15
- Acute Physiology and Chronic Health Evaluation II Score (APACHE II) on admission ≥10
- Sequential Organ Failure Assessment Score (SOFA) on admission ≥6.
EXCLUSION CRITERIA:
- Patient’s refusal
- Age < 18 years
- Pregnancy
- Patient with known pulmonary pathology that interferes with the interpretation of LUS: pneumectomy, pulmonary fibrosis, persistent pleural effusion
- Stage 5 chronic kidney disease or indication for emergency renal replacement therapy (RRT)
- Prolonged resuscitation (≥10 minutes) for cardiorespiratory arrest
RANDOMISATION
Patients included in this study will be randomly assigned to either LUS guided fluid management or usual care, in a 1:1 ratio, using block randomization. The randomized block design will be created using a computer-based program by a study team member not involved in patient enrollment and treatment. This team member will securely guard the randomized block design at the coordinating center and will provide the allocation sequence each time a new patient is enrolled in the study.
STUDY INTERVENTIONS
LUS guided fluid management (active group)
LUS guided fluid management is based on BLS assessment using LUS, within the first 24 hours of ICU admission, and daily thereafter, during ICU stay.
LUS examinations will be performed at bedside, with the patient in supine position, using 28 zone technique and the GE LOGIQ V2® ultrasound system with the GE 3Sc-RS Cardiac Sector Probe® (1.5 – 4.0 MHz frequency). The focus of the image will be set at the level of the pleural line and the depth of penetration at around 4-8 cm. The image will be optimized by regulating the gain. The lungs will be scanned, from the second to the fourth intercostal space on the left side, and from the second to the fifth intercostal space on the right side, at parasternal, mid-clavicular, anterior-axillary and mid-axillary lines. B-lines will be recorded in each intercostal space (28 sites of examination). The sum of all B-lines will produce a score, BLS, reflecting the extent of EVLW accumulation.
If BLS is <15, daily fluid balance will be maintained. If BLS is ≥15, a negative 24 hours fluid balance will be intended, through administration of intravenous diuretics. If a negative fluid balance of more than1000 ml/24 hours is obtained, and BLS is still ≥15, the initial dose of diuretic will be reduced. If a negative fluid balance of less than 1000 ml/24 hours is obtained and BLS is still ≥15, the administered diuretic dose will be maintained. If negative fluid balance is not achieved and BLS is still ≥15, the dose of diuretic will progressively be increased until the desired response is obtained. In case if there is a fall in blood pressure or an increase in creatinine blood level that is felt to be due to a transient episode of intravascular fluid depletion, the diuretic may be temporarily stopped, or the dose may be decreased. After the patient has stabilized and if BLS is ≥15, diuretics will be reinitiated until the patient’s BLS is <15. If the target of depleting overhydrated patients with diuretics cannot be achieved, RRT will be used.
As acute kidney injury (AKI) is often present in ICU patients, and RRT is a common procedure in critical care, to avoid bias, AKI will be diagnosed in all patients based on changes in the serum creatinine, urine output, or both, according to the KDIGO recommendations [48].
In patients requiring RRT the following criteria for RRT initiation will be used:
- Stage 3 AKI (urine output <0.3 mL/kg/h for ≥24h and/or >3-fold increase in serum creatinine level compared with baseline, or serum creatinine of ≥4 mg/dL with an acute increase of at least 0.5 mg/dL within 48 hours)
- Urine production lower than 200 mL/12h or anuria
- Serum potassium level higher than 6 mEq/L and/or with electrocardiographic abnormalities
- Organ edema in the presence of AKI resistant to diuretic treatment
- A pH below 7.15 in the context of either pure metabolic acidosis or mixed acidosis
- Acute pulmonary edema due to fluid overload responsible for severe hypoxemia despite diuretic therapy
Algorithm of study protocol
Recommended intravenous diuretic regimen in patients with BLS ≥15
| Furosemide (mg/day) | ||
| Previous daily Dose | Recommended daily dose | |
| 1 | ≤ 80 mg | 40 mg iv bolus + 5 mg/h |
| 2 | 81-160 mg | 80 mg iv bolus + 10 mg/h |
| 3 | 161-240 mg | 80 mg iv bolus + 20 mg/h |
| 4 | >240 mg | 80 mg iv bolus + 30 mg/h |
Usual care (control group)
Usual care is defined as the administration of fluids and diuretics in accordance to the routine clinical practice of the ICU physicians involved in patients’ treatment.
DATA COLLECTION
All patients will be followed up for the duration of 90 days from randomization and study participants data will be collected in paper-based Case Report Forms which will further serve to create a secure electronic database that will be analyzed.
Baseline data will include patients’ age, gender, weight and height, reason of ICU admission, data on chronic and acute pathology, data about recent immunosuppressive treatments, inflammatory status, infectious status and severity scores (APACHE II, SOFA, and only for polytrauma patient, ISS).
Starting from admission, SOFA severity score will be daily recorded, during ICU stay.
Physiological variables, temperature, heart rate, blood pressure, cardiac rhythm, peripheral blood oxygen saturation, presence of pulmonary crackles or edema, as well as routine laboratory tests, complete blood count, serum electrolytes, urea and creatinine, will be recorded every day, during ICU stay. All other monitoring parameters (e.g. invasive hemodynamic monitoring parameters) and laboratory tests (e.g. arterial-blood gas tests, central venous oxygen saturation, lactate level, inflammatory and infectious biomarkers) that may be imposed by case complexity and evolution, will be noted.
At inclusion, from all patients, regardless of the group allocation, Brain Natriuretic Peptide (NT-proBNP), Interleukin-6 (IL-6) and Neutrophil Gelatinase-Associated Lipocalin (NGAL) in serum samples, will be collected and analyzed centrally, using the Roche Elecsys® kit electro-chemiluminescence ‘sandwich’ immunoassays, based on polyclonal antibodies against IL-6, NGAL and NT-proBNP, respectively. Thereafter, the assessment of these biomarkers’ levels evolution will be performed in the 3rd, 5th and the 7th day of ICU stay, and weekly after, until ICU discharge.
Detailed data about daily fluid balance, including route, type and amount of fluid solutions received, and type and volume of fluid losses, as well as data upon diuretic therapy, will be collected from all patients, from the first to the last day of ICU stay.
Only in the active group, BLS will be daily recorded.
Presence and time-course evolution of organ dysfunctions, as well as specific therapeutic interventions will be recorded accordantly: haemodynamic support (type of drugs used, dose and duration of treatment), respiratory support (number of hours on mechanical ventilation), RRT (type, duration, dose of dialysis, volume of fluid removed, pre and post dialysis BLS in active group only).
OUTCOME
The main outcome will be 28-day survival. This will be established by a study team researcher, blinded to patient group assignment, based on hospital data or a brief telephonic interview with the patient or patients’ legally authorized representative or relative.
Secondary outcomes will include: presence and time-course evolution of organ dysfunctions during ICU stay, changes in SOFA severity score and different biomarkers’ level (NT-proBNP, IL-6, NGAL), ICU length of stay, total hospital length of stay, 90-day survival, resource utilization and cost-benefit ratio of fluid repletion solutions used (colloids, crystalloids). Secondary outcomes will be recorded based on collected data during ICU stay, hospital files, and a short telephonic interview with the patient or patients’ legally authorized representative to establish 90 days survival.
I. Scurt rezumat al proiectului
1. Stadiul actual al cunoasterii
Mortalitatea în Terapie Intensivă (TI) este foarte mare (între 20-50%). În cazul pacienţilor admişi în TI managementul volemic este extrem de important, dovedindu-se faptul că resuscitarea iniţială cu soluţii cristaloide creşte supravieţuirea. De asemeanea, managementul pacienţilor hipervolemici este la fel de important, hiperhidratarea determinȃnd apariţia insuficienţei respiratorii, creşterea duratei ventilaţiei mecanice sau decompensarea unei insuficienţe cardiace (1). Un studiu retrospectiv ce a cuprins peste 120 000 de pacienţi din TI, din peste 500 de spitale din Statele Unite a demonstrat faptul că pacienţii cu supraîncărcare volemică au o mortalitate mai mare (20% vs 16.8%), durată de spitalizare mai mare (11.5 vs 8 zile), durată de staţionare în TI mai mare (6.2 vs 3.6 zile), risc de readmitere în TI crescut (21.8% vs 21.3%) faţă de pacienţii cu un status volemic adecvat (1). Mortalitatea în TI este mai mare la pacienţii cu un bilant hidric pozitiv la 72 de ore de la admitere (2).
Folosirea unei singure metode pentru a evalua statusul volemic al unui pacient critic oferă informţii reduse (3). În schimb, combinarea mai multor metode creşte supravieţuire pacienţilor din TI. Ultrasonagrafia pulmonară (USP) reprezintă o noua metodă de determinare a statusului volemic (4).
În ultimii ani, utilizarea USP pentru detectarea apei pulmonare extravasculare a primit o atenţie deosebită în cercetarea clinică la pacienţii din secţiile de terapie intensivă (5). În mod normal, singura structură detectabilă ultrasonografic la nivel toracic este reprezentată de catre pleură, o linie orizontală hiperecogenă ce se mişcă sincron cu respiraţia. În momentul în care cantitatea de aer pulmonar scade (edemul pulmonar, fibroza pulmonară, etc.), undele ultrasonografice sunt reflectate şi apar ecografic anumite imagini. În prezenţa excesului lichidian pulmonar extravascular, undele ultrasonografice sunt reflectate de septurile interlobulare subpleurale îngroşate. Astfel se generează reverberaţii hiperecogene între septurile îngroşate şi pleura supradiacentă, artefacte ce sunt denumite “comete pulmonare” (6). Aceste comete pulmonare reprezintă echivalentul ultrasonografic al liniilor Kerley B din radiografia toracică standard, fiind uşor detectate cu traductori ultrasonografici obişnuiţi. Semnul “cometei pulmonare” este definit ca un semnal hiperecogen, un fascicul cu baza subţire ce se propagă de la nivelul transductorului până la marginea ecranului. În fiecare spaţiu intercostal se va înregistra numărul acestor “comete pulmonare” la nivelul liniei parasternale, medioclaviculare, axilare anterioare şi medioaxilare. Suma totală a acestora determină un scor (BLS) ce cuantifică lichidul extravascular de la nivel pulmonar. Se ştie faptul că un număr crescut de BLS este asociat cu creşterea mortalităţii în anumite populaţii (pacienţi cu insuficienţă cardiacă, dializaţi) (7). În mod remarcabil, cometele pulmonare se corelează cu presiunea de umplere a ventriculului stâng, iar determinarea apei extravasculare pulmonare cu ajutorul ultrasonografiei a fost validată anterior prin folosirea unei metode “gold standard” (8). Un studiu recent a demonstrat că la pacienții cu insuficienţă cardiacă evaluați în Ambulator cometele pulmonare au fost asociate cu diverși parametri de decompensare. Un număr mai mare sau egal cu 15 comete pulmonare poate fi considerat ca un prag rapid și sigur de evaluare a decompensării cardiace la pacienții cu insuficienţă cardiacă (9).
Pornind de la premisa că managementul volemic este extrem de important la pacienţii din TI, cred că folosind ultrasonografia pulmonară şi determinarea BLS poate îmbunătăţi statusul volemic şi supravieţuirea pacienţilor în TI.
- Protocol de studiu
2.1 Criterii de includere ȋn studiu:
Toti pacienţii critici adulţi cu vȃrsta mai mare sau egala cu 18 ani, care ȋndeplinesc cel puţin un criteriu din următoarele:
- Pacient critic chirurgical cu:
- Gastrectomie totală
- Duodenopancreatectomie cefalică
- Colectomie totală
- Esofagectomie
- Hepatectomie majoră
- Exenteraţie pelvină
- Rezecţie multiorgan
- Chirurgie vasculară majoră (Anevrism de aortă abdominală, By-Pass aorto-bifemural)
- Pacient chirurgical cu patologie cronică majoră asociată:
- BPOC cu CPC (Cord Pulmonar Cronic)
- ICC clasa III-IV NYHA
- Valvulopatii severe
- Ciroză hepatică clasa CHILD B sau C
- BRC cu Clearence de Creatinină >40 ml/min
- Pacient cu Politraumă cu scor ISS > 15.
- Urgenţe chirurgicale nontraumatice cu Scor APACHE II>10 şi SOFA>6
- Pacient critic medical sau chirurgical cu Scor APACHE II>10 şi SOFA>6
2.2. Criterii de excludere din studiu:
- Refuzul pacientului
- Pacient cu vȃrsta sub 18 ani
- Gravida
- Pacient cu patologie pulmonară ce interferă cu interpretarea ecografiei pulmonare: pneumectomie, fibroză pulmonară , pleurezie persistentă sau altă patologie locală
- Pacient cu criterii de CRRT de urgenţă
- Pacient cu BRC stdadiu V
- Pacient cu stop cardiorespirator resuscitat >10 minute
- Durata de internare ȋn TI sub 2 zile
- Transferul pacientului din/ȋn altă secţie de Terapie Intensivă din alt spital decȃt cele incluse ȋn studiu
- Pacient care a fost inclus în acest studiu şi se află la o nouă admitere în secţia de Terapia Intensivă
În acest studiu randomizat vor fi incluşi toţi pacienţii admişi în secţiile de TI din Institutul Regional de Oncologie Iaşi şi Spitalul Clinic Judeţean de Urgenţe Sfȃntul Spiridon, Iaşi, care prezintă cel puţin un criteriu de includere din cele enumerate anterior.
La includerea în studiu, pacienţilor li se va efectua o evaluare completă, constând în :
- date personale ale pacientului (vârstă, sex, mediu de provenienţă);
- factori de risc cardiovasculari (fumat, IMC);
- informaţii privitoare la medicaţie (IECA, ARAII);
- comorbidităţi (diabet zaharat tip1/2, cardiopatie ischemică, infarct miocardic, accident vascular cerebral, arteriopatie obliterantă a membrelor inferioare, alte afecţiuni)
- examen clinic obiectiv (tensiune arterială, frecvenţă cardiacă, raluri pulmonare, edeme periferice, etc.)
- evaluare paraclinică : hemoleucogramă, glicemie, acid uric, uree, creatinină, ionogramă, colesterol, trigliceride, proteine serice, CRP, procalcitonină.
- biomarkeri serici : NT-proBNP, NGAL şi IL 6.
Pacienţii vor fi randomizaţi în 2 grupe : grupul intervenţional – cărora li se va efectua ultrasonografie pulmonară şi se va determina BLS, administrarea de diuretice sau a soluţiilor de repleţie volemică fiind ghidată de BLS şi grupul control – a căror management lichidian nu va fi ghidat de către BLS. În grupul intervenţional se vor administra diuretice pentru a scădea BLS sub 15. De asemenea, în cazul în care pacienţii din grupul intervenţional vor necesita terapie de supleere a funcţiei renale, prin intermediul BLS se va ghida terapia de supleere a funcţiei renale.
2.3 Administrarea diureticelor în grupul intervenţional :
- Diureticul se va administra pentra a scădea BLS sub 15
- Dacă este necesar doza de diuretic se va creşte în mod progresiv pȃnă se obţine răspunsul dorit ;
- Dacă există o scădere a tensiunii arteriale sau o creştere a creatininei care poate fi considerată a fi secundară depleţiei intravasculare, administrarea diureticului poate fi oprită sau cantitatea de diuretic administrată poate fi scăzută.
- Dacă după 24h, BLS>15 şi:
– Bilanţul hidric este negativ >1000 ml, se poate reduce doza de diuretic administrată
– Bilanţul hidric este negativ <1000 ml, se menţine doza de diuretic administrată
– Bilanţul hidric este pozitiv, se creşte doza de diuretic administrată conform Tabel 1.
Tabel 1. Doze de diuretic recomandate
| Doza anterioară | Doza sugerată | ||
| Furosemid (mg/zi) | Furosemid | Hidroclorotiazida | |
| 1 | ≤ 80 mg/zi | 40 mg iv bolus+5mg/h | 0 |
| 2 | 81-160 mg/zi | 80 mg iv bolus+10mg/h | 12.5 mg |
| 3 | 161-240 mg/zi | 80 mg iv bolus+20mg/h | 25 mg |
| 4 | >240 mg/zi | 80 mg iv bolus+30mg/h | 25 mg |
2.4 Iniţierea dializei
Injuria renală acută (AKI) va fi diagnosticată pe baza modificărilor creatininei serice şi/sau scăderii diurezei (conform recomandărilor KDIGO). Creatinina serică va fi măsurată cel puţin o dată pe zi. Toţi pacienţii vor avea un cateter urinar şi diureza va fi măsurată în fiecare oră. Criterii de iniţiere a dializei :
- AKI stadiul 3 (diureza <0.3 mlkg/h pentru mai mult de 24h şi/sau creşterea nivelului seric al cretininei de 3 ori faţă valoarea de bază sau creatinina serică>4mg/dl cu o creştere de peste 0.5 mg/dl în ultimele 48h) ;
- Diureză <200 ml în ultimele 12h sau anurie;
- Potasiu seric >6 mEq/l cu modificări electrocardiografice;
- pH sangvin sub 7.15 în contextul unei acidoze metabolice pure (PaCO2<35mmHg) sau mixte (PaCO2≥50mmHg, fără posibilitatea de a creşte ventilaţia alveolară)
- edem pulmonar acut secundar supraîncărcării volemice ce determină hipoxemie severă fiind necesar un flux de oxigen peste 5L/min pentru a menţine SpO2 >95% sau un FiO2 mai mare de 50% la pacienţii ventilaţi mecanic în ciuda terapiei cu diuretice;
Evaluarea BLS:
- durata 8-10 minute;
- pacientul în decubit dorsal;
- evaluarea ultrasonografică a toracelui se va realiza la nivelul ambelor hemitorace, din al doilea până la al cincilea spaţiu intercostal (al patrulea la nivelul hemitoracelui stâng) si de la nivelul liniei parasternale până la cea medioaxilară.
2.5 Obiective
Principalul scop al acestui studiu este de a realiza un protocol, pentru pacienţii din TI, de management volemic bazat pe determinarea BLS. BLS va fi folosit în acest studiu pentru a ghida repleţia volemică în cazul pacienţilor hipovolemici sau de a corecta o posibilă supraîncărcare volemică. Studiile anterioare au arătat faptul ca un număr crescut al BLS este asociat cu o mortalitate crescută în anumite populaţii (pacienţi dializaţi, pacienţi cu insuficienţă cardiacă) (8).
Determinarea BLS este o metodă simplă, ce se poate realiza la patul pacientului, reproductibilă pentru determinarea statusul volemic al pacientului. Managementul volemic joacă un rol esenţial în TI şi credem faptul că un protocol pentru acest management bazat pe ultrasonografia pulmonară va îmbunătăţi mortalitatea în secţia de TI.
Acesta este primul studiu randomizat care va analiza rolul ultrasonografiei pulmonare în managementul volemic al pacienţilor din TI. Principalul outcome va fi reprezentat de mortalitatea la 28 de zile. Outcome-urile secundare sunt reprezentate de mortalitatea la 90 de zile, numărul zilelor de staţionare în terapie intensivă, numărul zilelor de spitalizare, necesarul de dializă, folosirea ventilaţiei mecanice, modificări ale unor biomarkeri (NTproBNP, IL 6, NGAL).
Bibliografie
- Zarbock A, Kellum J, Schmidt C, Van Aken H, Wempe C, Pavenstädt H, Boanta A, Gerß J, Meersch M. Effect of early vs delayed initiation of renal replacement therapy on mortality in critically ill patients with acute kidney injury. JAMA.2016 May 24-31;315(20):2190-9.
- Bart BA, Goldsmith SR, Lee KL, et al. Ultrafiltration in decompensated heart failure with cardiorenal syndrome. N Engl J Med 2012.
- C ostanzo MR GM, Saltzberg MT, Jessup ML, Bart BA, Teerlink JR, et al. Ultrafiltration versus intravenous diuretics for patients hospitalized for acute decompensated heart failure. J Am
Coll Cardiol. 2007;49:675-83. - Felker GM, Lee KL, Bull DA, et al. Diuretic strategies in patients with acute decompensated heart failure. N Engl J Med 2011;364:797-805.
- Picano E, Gargani L, Gheorghiade M. Why, when, and how to assess pulmonary congestion in heart failure: pathophysiological, clinical, and methodological implications. Heart Fail Rev 15:63–72, 2010.
- Picano E, Frassi F, Agricola E, Gligorova S, Gargani L, Mottola G. Ultrasound lung comets: a clinically useful sign of extravascular lung water. J Am Soc Echocardiogr 19: 356–63, 2006.
- Legrand M, Darmon M, Joannidis M, Payen D. Management of renal replacement therapy in ICU patients: an international survey. Intensive Care Med 2013;39: 101-8.
- Agricola E, Bove T, Oppizzi M, et al. “Ultrasound comet-tail images”: a marker of pulmonary edema: a comparative study with wedge pressure and extravascular lung water. Chest 127:1690 –5, 2005.
- Miglioranza MH, Gargani L, Sant’Anna RT, et al. Lung ultrasound for the evaluation of pulmonary congestion in outpatients: a comparison with clinical assessment, natriuretic peptides, and echocardiography. JACC Cardiovasc Imaging. 2013 Nov;6(11):1141-51.
Analiza statistica preliminara
Ca rezultate ale analizei statistice de etapa prezentam informatii legate de lotul de pacienti inclusi intr-unul din cele doua centre de studiu: Institutul Reginal de Oncologie Iasi.
Au fost inclusi pana la momentul embrie 2019 82 de pacienti: 34,15% femei si 65,85% barbati. Figura 1.
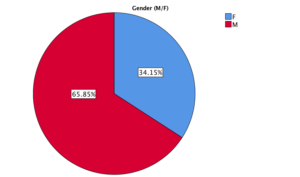
Figura 1. Distributia pe sexe a pacientilor inclusi in centrul de studiu IRO.
Varsta medie a pacientilor inclusi a fost de 64,5 +/- 9,1 ani.
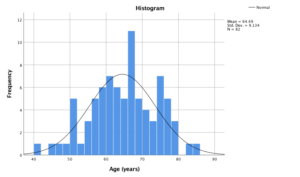
Figura 2. Distributia varstelor pacientilor inclusi in studiu in centrul IRO.
Datele antropometrice, scorul APACHE II (scorul predictiv pentru mortalitatea pacientilor din sectia de terapie intensiva) si scorul SOFA (Sequential Organ Failure Assessment) sunt detaliate in Tabelul 1.
Tabel 1. Date antropometrice, scorul APACHE II si SOFA.
| Minimum | Maximum | Mean | Std. Deviation | |
| Weight (Kg) | 50 | 117 | 71.68 | 12.421 |
| Height (cm) | 150 | 187 | 168.20 | 10.060 |
| BMI (Kg/m2) | 16.07 | 35.93 | 25.33 | 3.78 |
| APACHE II score on admission | 3 | 19 | 8.98 | 3.649 |
| SOFA score on admission | 0 | 10 | 2.93 | 2.510 |
Informatii legate de patologia asociata (comorbiditati, patologie chirurgicala asociata) sunt detaliate in Tabelele 2 – 27, atasate in ANEXA 1 atasata la finalul acestui raport de etapa
Au fost analizate statistic, in lotul de 82 de pacienti inclusi in centrul IRO (Institutul Regional de Oncologie) si outcome-urile primare: supravieturiea la 28 de zile si la 90 zile (in lotul total si comparative, in lotul interventional vs. lotul control).
In lotul total (brat interventional si brat control) supravietuirea la 28 de zile a fost de 95%, iar supravietuirea la 90 de zile a fost de 86,3%. Figura 3 si 4.
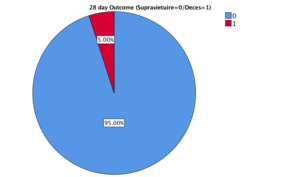
Figura 3. Supravietuirea in lotul total la 28 de zile.
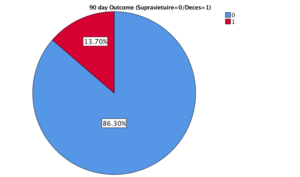
Figura 4. Supravietuirea in lotul total la 90 zile.
Analiza statistica preliminara, intr-un singur centru (IRO), a identificat o supravieturie de 94,6% la 28 de zile si 85,7% la 90 de zile in lotul interventional si respectiv 95,35% si 86,84% in lotul control, la 28 si 90 de zile. Figurile 5 si 6.
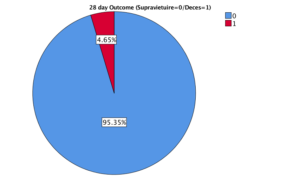
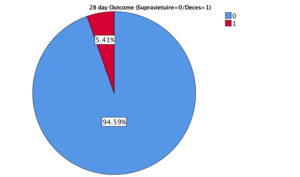
Figura 5. Supravietuirea la 28 de zile in lotul interventional vs lotul control.
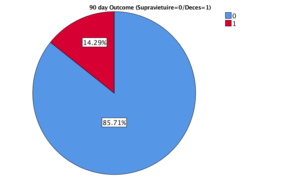
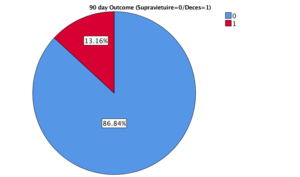
Figura 6. Supravietuirea la 90 de zile in lotul interventional vs. lotul control.
29 noiembrie 2019
Director de proiect: Prof. Dr. Adrian Covic
ANEXA 1. Tabelele 2 – 27.
Comorbiditati, patologie chirurgicala
Tabel 2.
| Surgical patient? (Yes=1/No=0) | |||||
| Frequency | Percent | Valid Percent | Cumulative Percent | ||
| Valid | 0 | 1 | 1.2 | 1.2 | 1.2 |
| 1 | 80 | 97.6 | 98.8 | 100.0 | |
| Total | 81 | 98.8 | 100.0 | ||
| Missing | System | 1 | 1.2 | ||
| Total | 82 | 100.0 | |||
Tabel 3.
| Emergency Surgery? (Yes=1/ No=0) | |||||
| Frequency | Percent | Valid Percent | Cumulative Percent | ||
| Valid | 0 | 77 | 93.9 | 95.1 | 95.1 |
| 1 | 4 | 4.9 | 4.9 | 100.0 | |
| Total | 81 | 98.8 | 100.0 | ||
| Missing | System | 1 | 1.2 | ||
| Total | 82 | 100.0 | |||
Tabel 4.
| Major Surgery? (Yes=1/No=0) | |||||
| Frequency | Percent | Valid Percent | Cumulative Percent | ||
| Valid | 0 | 2 | 2.4 | 2.5 | 2.5 |
| 1 | 79 | 96.3 | 97.5 | 100.0 | |
| Total | 81 | 98.8 | 100.0 | ||
| Missing | System | 1 | 1.2 | ||
| Total | 82 | 100.0 | |||
Tabel 5.
| Cancer Surgery? (Yes=1/No=0) | |||||
| Frequency | Percent | Valid Percent | Cumulative Percent | ||
| Valid | 0 | 2 | 2.4 | 2.5 | 2.5 |
| 1 | 79 | 96.3 | 97.5 | 100.0 | |
| Total | 81 | 98.8 | 100.0 | ||
| Missing | System | 1 | 1.2 | ||
| Total | 82 | 100.0 | |||
Tabel 6.
| Metastatic Cancer? (Yes=1/No=0) | |||||
| Frequency | Percent | Valid Percent | Cumulative Percent | ||
| Valid | 0 | 65 | 79.3 | 85.5 | 85.5 |
| 1 | 11 | 13.4 | 14.5 | 100.0 | |
| Total | 76 | 92.7 | 100.0 | ||
| Missing | System | 6 | 7.3 | ||
| Total | 82 | 100.0 | |||
Tabel 7.
| Preoperative RTE/CHT (Yes=1/No=0) | |||||
| Frequency | Percent | Valid Percent | Cumulative Percent | ||
| Valid | 0 | 66 | 80.5 | 86.8 | 86.8 |
| 1 | 10 | 12.2 | 13.2 | 100.0 | |
| Total | 76 | 92.7 | 100.0 | ||
| Missing | System | 6 | 7.3 | ||
| Total | 82 | 100.0 | |||
Tabel 8.
| Major Chronic co-morbid diseases? (Yes=1/No=0) | |||||
| Frequency | Percent | Valid Percent | Cumulative Percent | ||
| Valid | 0 | 56 | 68.3 | 84.8 | 84.8 |
| 1 | 10 | 12.2 | 15.2 | 100.0 | |
| Total | 66 | 80.5 | 100.0 | ||
| Missing | System | 16 | 19.5 | ||
| Total | 82 | 100.0 | |||
Tabel 9.
| Chronic respiratory diseases (Yes=1/No=0) | |||||
| Frequency | Percent | Valid Percent | Cumulative Percent | ||
| Valid | 0 | 60 | 73.2 | 90.9 | 90.9 |
| 1 | 6 | 7.3 | 9.1 | 100.0 | |
| Total | 66 | 80.5 | 100.0 | ||
| Missing | System | 16 | 19.5 | ||
| Total | 82 | 100.0 | |||
Tabel 10.
| Chronic cardio-vascular diseases (Yes=1/No=0) | |||||
| Frequency | Percent | Valid Percent | Cumulative Percent | ||
| Valid | 0 | 29 | 35.4 | 43.9 | 43.9 |
| 1 | 37 | 45.1 | 56.1 | 100.0 | |
| Total | 66 | 80.5 | 100.0 | ||
| Missing | System | 16 | 19.5 | ||
| Total | 82 | 100.0 | |||
Tabel 11.
| Chronic kidney diseases (Yes=1/No=0) | |||||
| Frequency | Percent | Valid Percent | Cumulative Percent | ||
| Valid | 0 | 51 | 62.2 | 77.3 | 77.3 |
| 1 | 15 | 18.3 | 22.7 | 100.0 | |
| Total | 66 | 80.5 | 100.0 | ||
| Missing | System | 16 | 19.5 | ||
| Total | 82 | 100.0 | |||
Tabel 12.
| Chronic haematological diseases (Yes=1/No=0) | |||||
| Frequency | Percent | Valid Percent | Cumulative Percent | ||
| Valid | 0 | 53 | 64.6 | 80.3 | 80.3 |
| 1 | 13 | 15.9 | 19.7 | 100.0 | |
| Total | 66 | 80.5 | 100.0 | ||
| Missing | System | 16 | 19.5 | ||
| Total | 82 | 100.0 | |||
Tabel 15.
| Chronic neurological diseases (Yes=1/No=0) | |||||
| Frequency | Percent | Valid Percent | Cumulative Percent | ||
| Valid | 0 | 64 | 78.0 | 97.0 | 97.0 |
| 1 | 2 | 2.4 | 3.0 | 100.0 | |
| Total | 66 | 80.5 | 100.0 | ||
| Missing | System | 16 | 19.5 | ||
| Total | 82 | 100.0 | |||
Tabel 16.
| Chronic immune diseases (Yes=1/No=0) | |||||
| Frequency | Percent | Valid Percent | Cumulative Percent | ||
| Valid | 0 | 66 | 80.5 | 100.0 | 100.0 |
| Missing | System | 16 | 19.5 | ||
| Total | 82 | 100.0 | |||
Tabel 17.
| Diabetes Mellitus (Yes=1/No=0) | |||||
| Frequency | Percent | Valid Percent | Cumulative Percent | ||
| Valid | 0 | 52 | 63.4 | 78.8 | 78.8 |
| 1 | 14 | 17.1 | 21.2 | 100.0 | |
| Total | 66 | 80.5 | 100.0 | ||
| Missing | System | 16 | 19.5 | ||
| Total | 82 | 100.0 | |||
Tabel 18.
| Cirrhosis (Yes=1/No=0) | |||||
| Frequency | Percent | Valid Percent | Cumulative Percent | ||
| Valid | 0 | 63 | 76.8 | 95.5 | 95.5 |
| 1 | 3 | 3.7 | 4.5 | 100.0 | |
| Total | 66 | 80.5 | 100.0 | ||
| Missing | System | 16 | 19.5 | ||
| Total | 82 | 100.0 | |||
Tabel 19.
| Other Chronic diseases (Yes=1/No=0) | |||||
| Frequency | Percent | Valid Percent | Cumulative Percent | ||
| Valid | 0 | 66 | 80.5 | 100.0 | 100.0 |
| Missing | System | 16 | 19.5 | ||
| Total | 82 | 100.0 | |||
Tabel 20.
| Baseline Sepsis (Yes=1/No=0) | |||||
| Frequency | Percent | Valid Percent | Cumulative Percent | ||
| Valid | 0 | 56 | 68.3 | 84.8 | 84.8 |
| 1 | 10 | 12.2 | 15.2 | 100.0 | |
| Total | 66 | 80.5 | 100.0 | ||
| Missing | System | 16 | 19.5 | ||
| Total | 82 | 100.0 | |||
Tabel 21.
| Baseline Septic shock (Yes=1/No=0) | |||||
| Frequency | Percent | Valid Percent | Cumulative Percent | ||
| Valid | 0 | 65 | 79.3 | 98.5 | 98.5 |
| 1 | 1 | 1.2 | 1.5 | 100.0 | |
| Total | 66 | 80.5 | 100.0 | ||
| Missing | System | 16 | 19.5 | ||
| Total | 82 | 100.0 | |||
Tabel 22.
| Baseline Respiratory system infection (Yes=1/No=0) | |||||
| Frequency | Percent | Valid Percent | Cumulative Percent | ||
| Valid | 0 | 66 | 80.5 | 100.0 | 100.0 |
| Missing | System | 16 | 19.5 | ||
| Total | 82 | 100.0 | |||
Tabel 23.
| Baseline Intra-abdominal infection (Yes=1/No=0) | |||||
| Frequency | Percent | Valid Percent | Cumulative Percent | ||
| Valid | 0 | 59 | 72.0 | 89.4 | 89.4 |
| 1 | 7 | 8.5 | 10.6 | 100.0 | |
| Total | 66 | 80.5 | 100.0 | ||
| Missing | System | 16 | 19.5 | ||
| Total | 82 | 100.0 | |||
Tabel 24.
| Baseline Urinary tract infection (Yes=1/No=0) | |||||
| Frequency | Percent | Valid Percent | Cumulative Percent | ||
| Valid | 0 | 60 | 73.2 | 90.9 | 90.9 |
| 1 | 6 | 7.3 | 9.1 | 100.0 | |
| Total | 66 | 80.5 | 100.0 | ||
| Missing | System | 16 | 19.5 | ||
| Total | 82 | 100.0 | |||
Tabel 25.
| Baseline Soft tissue infection (Yes=1/No=0) | |||||
| Frequency | Percent | Valid Percent | Cumulative Percent | ||
| Valid | 0 | 66 | 80.5 | 100.0 | 100.0 |
| Missing | System | 16 | 19.5 | ||
| Total | 82 | 100.0 | |||
Tabel 26.
| Baseline Blood stream infection (Yes=1/No=0) | |||||
| Frequency | Percent | Valid Percent | Cumulative Percent | ||
| Valid | 0 | 65 | 79.3 | 98.5 | 98.5 |
| 1 | 1 | 1.2 | 1.5 | 100.0 | |
| Total | 66 | 80.5 | 100.0 | ||
| Missing | System | 16 | 19.5 | ||
| Total | 82 | 100.0 | |||
Tabel 27.
| Baseline other infection (Yes=1/No=0) | |||||
| Frequency | Percent | Valid Percent | Cumulative Percent | ||
| Valid | 0 | 66 | 80.5 | 100.0 | 100.0 |
| Missing | System | 16 | 19.5 | ||
| Total | 82 | 100.0 | |||